20 mg de sciences in situ : Le H.I.V, une histoire de clefs et serrure
Publié par Morgane Bouterre, le 16 juillet 2018 2k
Diffusion sur Campus FM (94 MHz à Toulouse) le dimanche 6 avril 2014.
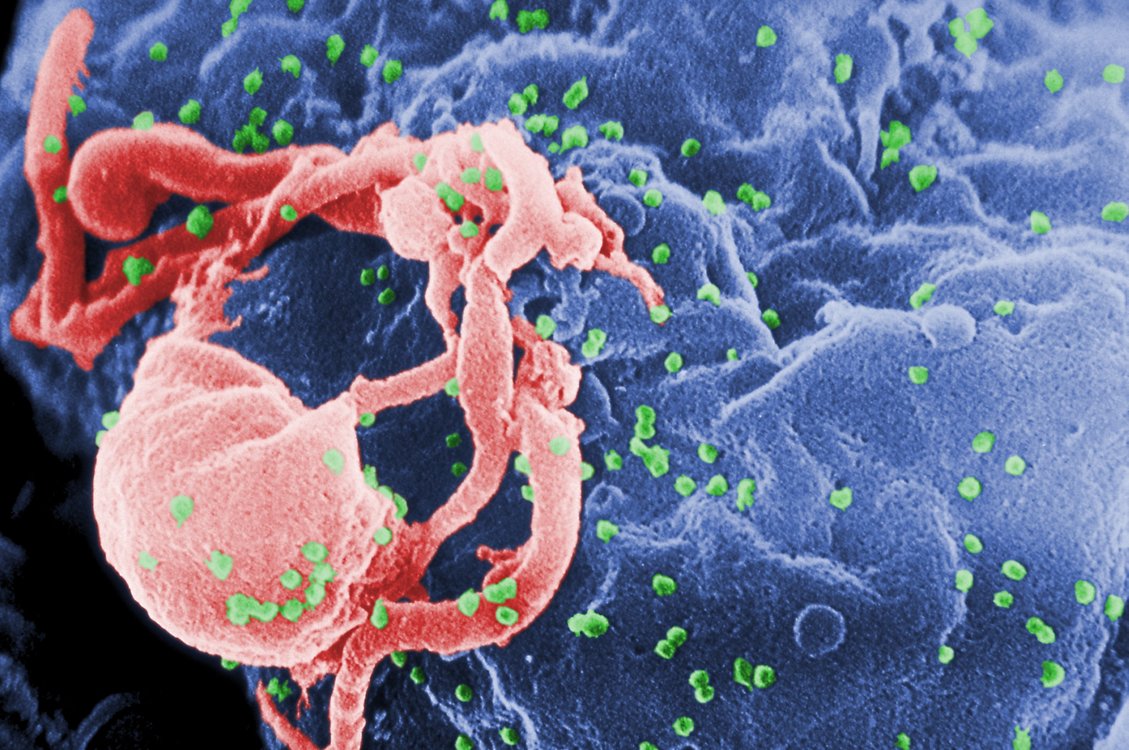
Fabrice Dumas est Maître de conférence à l’Université Paul Sabatier. Ses recherches menées au sein de l’équipe Dynamique fonctionnelle des membranes biologiques et de la molécule d’ADN installée à l’IPBS (Institut de Pharmacologie et de Biologie Structurale) portent sur la compréhension des interactions entre le VIH (virus de l’immunodéficience humaine) et des cellules de notre système immunitaire. Ces interactions permettent au virus de pénétrer ces cellules, il les utilise ensuite pour se multiplier. Le VIH possède pour cela deux clés, situées sur une glycoprotéine transmembranaire appelée gp120, qui actionnent deux serrures de nos cellules immunitaires : un récepteur (le CD4) et son co-récepteur (le CXCR4 ou le CCR5).
Ces clés ne fonctionnent que si les deux serrures sont proches l’une de l’autre, or ces dernières sont réparties à la surface des cellules et s’y déplacent. Des marqueurs fluorescents greffés sur les serrures permettent de visualiser et d’étudier leurs déplacements lorsqu’elles interagissent avec les clés du virus ou lorsque certains médicaments empêchent ces interactions. Les mouvements et les regroupements de ces serrures ont un impact direct sur la capacité des virus à entrer dans les cellules et donc sur leur virulence : leur compréhension aidera à optimiser les traitements existants et à développer de nouveaux moyens de lutte contre le SIDA.
Une glycoprotéine transmembranaire est une grosse molécule composée d’acides aminés (comme toutes les protéines) et de saccharides (des sucres) qui est insérée dans une membrane et émerge de celle-ci.
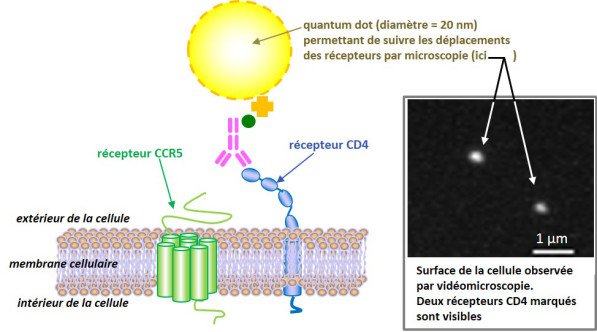
Illustration F. Dumas (copyright CNRS)
Plus d'infos :
IPBS